कुछ रसायनों द्वारा एंजाइमों की क्रिया को पूरी तरह या आंशिक रूप से दबाया (अवरुद्ध) किया जा सकता है। - अवरोधक (चित्र। 8)।
उनकी कार्रवाई की प्रकृति से अवरोधकोंउपविभाजित प्रतिवर्ती और अपरिवर्तनीय।यह विभाजन अवरोधक-एंजाइम बंधन की ताकत पर आधारित है।
प्रतिवर्ती अवरोधकयौगिक हैं कि गैर सहसंयोजकएंजाइम के साथ बातचीत करता है और एंजाइम से अलग हो सकता है।
प्रतिस्पर्द्धी।प्रतिस्पर्धी अवरोधक सक्रिय साइट के सब्सट्रेट-बाइंडिंग साइट पर बाध्यकारी के लिए सब्सट्रेट के साथ प्रतिस्पर्धा करता है और एंजाइम को सब्सट्रेट के समान तरीके से बांधता है। लेकिन एंजाइम से जुड़े प्रतिस्पर्धी अवरोधक एंजाइमी रूपांतरण से नहीं गुजरते हैं। प्रतिस्पर्धी निषेध की एक विशिष्ट विशेषता यह है कि इसे कमजोर या पूरी तरह से समाप्त किया जा सकता है, सब्सट्रेट की एकाग्रता में वृद्धि करके। कई दवाएं प्रतिस्पर्धी एंजाइम अवरोधक हैं।
उदाहरण। संक्रामक रोगों के इलाज के लिए इस्तेमाल की जाने वाली सल्फा दवाएं। सल्फानिलमाइड्स पैरा-एमिनोबेंजोइक एसिड के संरचनात्मक एनालॉग हैं, जिसमें से एक कोएंजाइम (एच 4 - फोलेट) एक सूक्ष्मजीव की कोशिका में संश्लेषित होता है, जो न्यूक्लिक बेस के जैवसंश्लेषण में शामिल होता है। न्यूक्लिक एसिड के संश्लेषण का उल्लंघन सूक्ष्मजीवों की मृत्यु की ओर जाता है।
प्रतिवर्ती निषेध हो सकता है गैर - प्रतिस्पर्धीसब्सट्रेट के संबंध में; इस मामले में, अवरोधक एंजाइम में एक ही साइट के लिए सब्सट्रेट के साथ प्रतिस्पर्धा नहीं करता है।
एक गैर-प्रतिस्पर्धी अवरोधक एक सब्सट्रेट की उपस्थिति और अनुपस्थिति दोनों में एंजाइम को बांध सकता है; सब्सट्रेट एकाग्रता में वृद्धि अवरोधक के बंधन को नहीं रोकती है (चित्र 9)। एक गैर-प्रतिस्पर्धी अवरोधक वास्तव में सक्रिय एंजाइम की मात्रा को कम करता है।
बंधन से एंजाइम की संरचना में परिवर्तन होता है और सब्सट्रेट के लिए पूरकता का उल्लंघन होता है। गैर-प्रतिस्पर्धी अवरोधक मुक्त एंजाइम और ईएस कॉम्प्लेक्स दोनों के लिए विपरीत रूप से बांध सकते हैं। सबसे महत्वपूर्ण गैर-प्रतिस्पर्धी अवरोधक एक जीवित कोशिका में बनने वाले मध्यवर्ती चयापचय उत्पाद हैं जो कुछ एंजाइम साइटों (एलोस्टेरिक केंद्रों) से उलट सकते हैं और उनकी गतिविधि को बदल सकते हैं, जो चयापचय को विनियमित करने के तरीकों में से एक है।
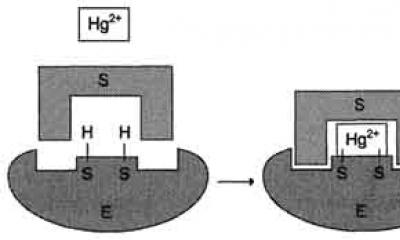
अपरिवर्तनीय अवरोधक -ये यौगिक हैं जो विशेष रूप से सक्रिय केंद्र के कुछ कार्यात्मक रूप से महत्वपूर्ण समूहों को बांध सकते हैं सहसंयोजक, मजबूत बंधनएक एंजाइम के साथ। साथ ही, वे अपरिवर्तनीय रूप से, अक्सर सहसंयोजक रूप से, एंजाइम या एंजाइम-सब्सट्रेट कॉम्प्लेक्स से बंधते हैं और अपरिवर्तनीय रूप से मूल संरचना को बदल देते हैं। कुछ जहरीले पदार्थों की क्रिया एंजाइम गतिविधि के निषेध पर आधारित होती है, उदाहरण के लिए, आर्सेनिक यौगिक, एचजी 2+, पीबी 2+
उदाहरण Diisopropylfluorophosphate सक्रिय साइट पर सेरीन वाले एंजाइम को रोकता है। ऐसा एंजाइम एसिटाइलकोलिनेस्टरेज़ है, जो निम्नलिखित प्रतिक्रिया को उत्प्रेरित करता है:
एक प्रतिक्रिया तब होती है जब हर बार एक तंत्रिका आवेग आयोजित किया जाता है, इससे पहले कि एक दूसरे आवेग को सिनैप्स में प्रसारित किया जाता है। डायसोप्रोपाइलफ्लोरोफॉस्फेट विषाक्त तंत्रिका एजेंटों में से एक है, क्योंकि यह तंत्रिका आवेगों को संचालित करने के लिए न्यूरॉन्स की क्षमता के नुकसान की ओर जाता है।
उदाहरण। एंटीपीयरेटिक और एंटी-इंफ्लेमेटरी एजेंट के रूप में एस्पिरिन के चिकित्सीय प्रभाव को इस तथ्य से समझाया गया है कि एस्पिरिन प्रोस्टाग्लैंडीन (पीजी) के संश्लेषण को उत्प्रेरित करने वाले एंजाइमों में से एक को रोकता है। प्रोस्टाग्लैंडिंस सूजन के विकास में शामिल पदार्थ हैं। निषेध एंजाइम के अमीनो समूहों में से एक के सहसंयोजक संशोधन के कारण है - प्रोस्टाग्लैंडीन सिंथेटेज़।
अवरोधक अणु और एंजाइम के बीच सहसंयोजक स्थिर बंधों के निर्माण के मामले में अपरिवर्तनीय अवरोध देखा जाता है। अक्सर, एंजाइम की सक्रिय साइट में संशोधन होता है। नतीजतन, एंजाइम अपना उत्प्रेरक कार्य नहीं कर सकता है।
प्रति अपरिवर्तनीय अवरोधकों में भारी आयन शामिल हैंधातु, जैसे पारा (Hg 2+), सिल्वर (Ag +) और आर्सेनिक (As 3+), जो कम सांद्रता में सक्रिय केंद्र के सल्फहाइड्रील समूहों को अवरुद्ध करते हैं। इस मामले में, सब्सट्रेट रासायनिक परिवर्तन से नहीं गुजर सकता है।
डायसोप्रोपाइलफ्लोरोफॉस्फेट (DFF)एंजाइम की सक्रिय साइट में कई सेरीन अवशेषों में से केवल एक के साथ विशेष रूप से प्रतिक्रिया करता है। डीपीपी के साथ प्रतिक्रिया करने में सक्षम सेर अवशेषों में एक समान या बहुत समान अमीनो एसिड वातावरण होता है। अन्य सेर अवशेषों की तुलना में इस अवशेष की उच्च प्रतिक्रियाशीलता अमीनो एसिड अवशेषों के कारण होती है जो एंजाइमों के सक्रिय केंद्र में भी शामिल होते हैं।
डीपीपी को "सेरीन" एंजाइमों के एक विशिष्ट अपरिवर्तनीय अवरोधक के रूप में वर्गीकृत किया गया है, क्योंकि यह सेरीन के हाइड्रॉक्सिल समूह के साथ एक सहसंयोजक बंधन बनाता है, जो सक्रिय केंद्र में स्थित है और उत्प्रेरण प्रक्रिया में महत्वपूर्ण भूमिका निभाता है।
मोनोआइएसेटिक अम्ल, p-chloromercuribenzoate प्रोटीन सिस्टीन अवशेषों के SH-समूहों के साथ आसानी से प्रतिक्रिया करता है। इन अवरोधकों को विशिष्ट के रूप में वर्गीकृत नहीं किया जाता है, क्योंकि वे प्रोटीन के किसी भी मुक्त एसएच-समूह के साथ प्रतिक्रिया करते हैं और गैर-विशिष्ट अवरोधक कहलाते हैं। यदि एसएच समूह सीधे उत्प्रेरण में शामिल होते हैं, तो इन अवरोधकों की सहायता से उत्प्रेरण में एंजाइम के एसएच समूहों की भूमिका को प्रकट करना संभव लगता है।
दवाओं के रूप में अपरिवर्तनीय एंजाइम अवरोधक
एक दवा का एक उदाहरण जिसकी क्रिया अपरिवर्तनीय एंजाइम निषेध पर आधारित है, व्यापक रूप से उपयोग की जाने वाली दवा है एस्पिरिन. विरोधी भड़काऊ गैर-स्टेरायडल दवा एस्पिरिन एंजाइम के निषेध के कारण औषधीय कार्रवाई प्रदान करती है साइक्लोऑक्सीजिनेजएराकिडोनिक एसिड से प्रोस्टाग्लैंडीन के निर्माण को उत्प्रेरित करता है। एक रासायनिक प्रतिक्रिया के परिणामस्वरूप, एस्पिरिन का एसिटाइल अवशेष साइक्लोऑक्सीजिनेज सेरीन के मुक्त टर्मिनल ओएच समूह से जुड़ा होता है।
यह प्रोस्टाग्लैंडीन प्रतिक्रिया उत्पादों के गठन में कमी का कारण बनता है, जिसमें सूजन के मध्यस्थों सहित जैविक कार्यों की एक विस्तृत श्रृंखला होती है।
प्रतिवर्ती निषेध
प्रतिवर्ती अवरोधक कमजोर गैर-सहसंयोजक बंधों द्वारा एंजाइम से बंधते हैं और कुछ शर्तों के तहत, आसानी से एंजाइम से अलग हो जाते हैं। प्रतिवर्ती अवरोधक या तो प्रतिस्पर्धी या गैर-प्रतिस्पर्धी हैं।
प्रतिस्पर्धी निषेध
प्रतिस्पर्धात्मक निषेध एक अवरोधक के कारण एंजाइमी प्रतिक्रिया की दर में एक प्रतिवर्ती कमी को संदर्भित करता है जो एंजाइम की सक्रिय साइट से बांधता है और एंजाइम-सब्सट्रेट कॉम्प्लेक्स के गठन को रोकता है। इस प्रकार का निषेध तब देखा जाता है जब अवरोधक सब्सट्रेट का संरचनात्मक एनालॉग होता है; परिणामस्वरूप, एंजाइम के सक्रिय स्थल में एक स्थान के लिए सब्सट्रेट और अवरोधक अणुओं के बीच प्रतिस्पर्धा होती है। इस मामले में, या तो सब्सट्रेट या अवरोधक एंजाइम के साथ संपर्क करता है, एंजाइम-सब्सट्रेट (ईएस) या एंजाइम-इनहिबिटर (ईआई) कॉम्प्लेक्स बनाता है। जब एंजाइम और अवरोधक (ईआई) का परिसर बनता है, तो प्रतिक्रिया उत्पाद नहीं बनता है।
क्लासिक उदाहरणप्रतिस्पर्धी निषेध - निषेध सक्सेनेट डिहाइड्रोजनेजमेलोनिक एसिड के साथ प्रतिक्रिया। मैलोनिक एसिड सक्सेनेट (दो कार्बोक्सिल समूहों की उपस्थिति) का एक संरचनात्मक एनालॉग है और यह सक्सेनेट डिहाइड्रोजनेज की सक्रिय साइट के साथ भी बातचीत कर सकता है। हालांकि, मैलोनिक एसिड से दो हाइड्रोजन परमाणुओं का उन्मूलन असंभव है; इसलिए, प्रतिक्रिया की दर कम हो जाती है।
अपरिवर्तनीय अवरोधकों का उपयोग स्पष्ट करने के लिए बहुत रुचि का है
अप्रतिस्पर्धी निषेध।अप्रतिस्पर्धी निषेध के साथ अवरोधक केवल एंजाइम-सब्सट्रेट परिसर को बांधता हैलेकिन मुक्त एंजाइम के साथ नहीं। सब्सट्रेट, एंजाइम के लिए बाध्य, इसकी संरचना को बदलता है, जिससे अवरोधक को बांधना संभव हो जाता है। अवरोधक एंजाइम की संरचना को बदलता हैताकि कटैलिसीस असंभव हो जाता है।यह विशेषता है कि V और K एक ही हद तक बदलते हैं।
सब्सट्रेट निषेध- अप्रतिस्पर्धी निषेध का एक विशेष मामला, जब दो सब्सट्रेट अणु एंजाइम से बंधते हैं, जो उत्पाद के निर्माण को रोकता है।
एलोस्टेरिक निषेध: अवरोधक बाँधएंजाइम के अलग-अलग वर्गों के साथ सक्रिय केंद्र के बाहर।यह लिंकिंग शामिल है एंजाइम अणु में गठनात्मक परिवर्तन, जिससे इसकी गतिविधि में कमी आती है. ऑलिगोमेरिक एंजाइमों के मामले में एलोस्टेरिक प्रभाव लगभग विशेष रूप से होते हैं। इस तरह के सिस्टम के कैनेटीक्स को एक साधारण माइकलिस-मेंटेन मॉडल का उपयोग करके वर्णित नहीं किया जा सकता है।
अपरिवर्तनीय निषेधगठन के मामले में मनाया गया सहसंयोजक अवरोधक अणु और एंजाइम के बीच स्थिर बंधन. अक्सर, परिणामस्वरूप एंजाइम की सक्रिय साइट में संशोधन होता है एंजाइम एक उत्प्रेरक कार्य नहीं कर सकता.
अपरिवर्तनीय अवरोधकों में पारा (एचजी 2+), चांदी (एजी +) और आर्सेनिक (3+ के रूप में) जैसे भारी धातु आयन शामिल हैं, जो कम सांद्रता में सक्रिय केंद्र के सल्फहाइड्रील समूहों को अवरुद्ध करते हैं। इस मामले में, सब्सट्रेट रासायनिक परिवर्तन से नहीं गुजर सकता है। रिएक्टिवेटर्स की उपस्थिति में, एंजाइमेटिक फ़ंक्शन बहाल हो जाता है. उच्च सांद्रता में, भारी धातु आयन एंजाइम के प्रोटीन अणु के विकृतीकरण का कारण बनते हैं, अर्थात। एंजाइम की पूर्ण निष्क्रियता के लिए नेतृत्व। 
विशिष्ट और गैर-विशिष्ट अवरोधक
एंजाइम क्रिया के तंत्र को स्पष्ट करने के लिए अपरिवर्तनीय अवरोधकों का उपयोग बहुत रुचि का है। इस उद्देश्य के लिए आवेदन करें पदार्थ जो एंजाइमों के सक्रिय केंद्र के कुछ समूहों को अवरुद्ध करते हैं। ऐसे अवरोधकों को कहा जाता हैविशिष्ट।
कई यौगिक कुछ रासायनिक समूहों के साथ आसानी से प्रतिक्रिया करते हैं। यदि ये समूह कटैलिसीस में शामिल हैं, तो एंजाइम की पूर्ण निष्क्रियता होती है। डायसोप्रोपाइलफ्लोरोफॉस्फेट
(डीएफएफ)"सेरीन" एंजाइमों के विशिष्ट अपरिवर्तनीय अवरोधकों के रूप में वर्गीकृत किया जाता है, क्योंकि यह सेरीन के हाइड्रॉक्सिल समूह के साथ एक सहसंयोजक बंधन बनाता है, जो सक्रिय केंद्र में स्थित होता है और उत्प्रेरण प्रक्रिया में महत्वपूर्ण भूमिका निभाता है। 
आयोडीन एसीटेट, p-chloromercuribenzoateप्रोटीन सिस्टीन अवशेषों के एसएच-समूहों के साथ आसानी से प्रतिक्रिया करता है। इन अवरोधकों को विशिष्ट के रूप में वर्गीकृत नहीं किया गया है, क्योंकि वे प्रोटीन के किसी भी मुक्त एसएच-समूह के साथ प्रतिक्रिया करते हैं और उन्हें गैर-विशिष्ट अवरोधक कहा जाता है।यदि एसएच समूह सीधे उत्प्रेरण में शामिल होते हैं, तो इन अवरोधकों की सहायता से उत्प्रेरण में एंजाइम के एसएच समूहों की भूमिका को प्रकट करना संभव लगता है।
एक दवा का एक उदाहरण जिसकी क्रिया अपरिवर्तनीय एंजाइम निषेध पर आधारित है, व्यापक रूप से उपयोग की जाने वाली दवा है एस्पिरिन. विरोधी भड़काऊ गैर-स्टेरायडल दवा एस्पिरिन साइक्लोऑक्सीजिनेज एंजाइम को रोककर एक औषधीय प्रभाव प्रदान करती है, जो एराकिडोनिक एसिड से प्रोस्टाग्लैंडीन के गठन को उत्प्रेरित करता है। एक रासायनिक प्रतिक्रिया के परिणामस्वरूप, एस्पिरिन का एसिटाइल अवशेष साइक्लोऑक्सीजिनेज सबयूनिट्स में से एक के मुक्त टर्मिनल NH 2 समूह से जुड़ा होता है। यह प्रोस्टाग्लैंडीन प्रतिक्रिया उत्पादों के गठन में कमी का कारण बनता है, जिसमें सूजन के मध्यस्थों सहित जैविक कार्यों की एक विस्तृत श्रृंखला होती है।

एंजाइमों की गतिविधि को विनियमित करने के मुख्य तरीके:
एलोस्टेरिक विनियमन;
प्रोटीन-प्रोटीन इंटरैक्शन द्वारा विनियमन;
एंजाइम अणु के फॉस्फोराइलेशन/डीफॉस्फोराइलेशन द्वारा विनियमन;
आंशिक (सीमित) प्रोटियोलिसिस द्वारा विनियमन।
चयापचय पथों में रासायनिक प्रतिक्रियाओं का संगठन
एक जीवित कोशिका एक खुली प्रणाली है, जबकि यह अपनी आंतरिक संरचना को अपरिवर्तित रखने का प्रयास करती है - सेलुलर होमियोस्टेसिस. चयापचय - शरीर की कोशिकाओं में होने वाले सभी चयापचय मार्गों की समग्रता। विपरीत रूप से निर्देशित प्रक्रियाएं हैं: अपचय और उपचय। अपचय- ऊर्जा की रिहाई के साथ जटिल पदार्थों का सरल में टूटना। उपचय -सरल अधिक जटिल पदार्थों से संश्लेषण। चयापचय मार्ग मान गयाआपस में स्थान, समय और प्रवाह की तीव्रता, जो विनियमन के जटिल और विविध तंत्रों द्वारा सुनिश्चित की जाती है।
प्रतिक्रियाओं को उत्प्रेरित करने वाले एंजाइमों की इष्टतम गतिविधि एक चयापचय मार्ग, कोशिका में एक निश्चित स्थानिक संगठन के कारण प्राप्त होता है।
गैर-विशिष्ट अवरोधक. हर्स्ट द्वारा 1942 में सामान्य मानव और पशु रक्त सीरा में इन्फ्लूएंजा वायरस के अवरोधकों की खोज की गई थी।
शरीर की कोशिकाएं विशेष विरोट्रोपिक पदार्थ उत्पन्न करती हैं - अवरोधक जो वायरस से बातचीत कर सकते हैं और उनकी गतिविधि को दबा सकते हैं। इस प्रकार, सीरम अवरोधकों में कार्रवाई की एक विस्तृत श्रृंखला होती है: कुछ वायरस के हेमाग्लगुटिनेटिंग गुणों को दबाते हैं, अन्य - उनकी संक्रामक गतिविधि। सीरम अवरोधकों को विभाजित किया जाता है: हीट-लैबाइल (चू-इनहिबिटर, β-इनहिबिटर), जो 60-62 डिग्री सेल्सियस के तापमान पर निष्क्रिय होते हैं। वे इन्फ्लूएंजा वायरस, खसरा, न्यूकैसल रोग, आदि की संक्रामक और रक्तगुल्म गतिविधि को बेअसर करने में सक्षम हैं; थर्मोस्टेबल (फ्रांसिस, α- और γ-अवरोधक)। वे विषाणु की हीमाग्लगुटिनेटिंग गतिविधि को अवरुद्ध करते हैं।
विभिन्न वायरस (एक ही प्रजाति के भी) अवरोधकों के प्रति उनकी संवेदनशीलता में भिन्न होते हैं। अवरोधक-संवेदनशील और अवरोधक-प्रतिरोधी उपभेद हैं।
विभिन्न प्रजातियों के जानवरों के रक्त सीरा में अवरोधकों की जैव रासायनिक प्रकृति और उनकी मात्रात्मक सामग्री में गहरा अंतर स्थापित किया गया है।
वायरस के साथ उनकी बातचीत में अवरोधक और एंटीबॉडी के बीच अंतर होता है। इस प्रकार, एंटीबॉडी के विपरीत, अवरोधक-वायरस परिसर पूरक को ठीक नहीं करता है; एंटीबॉडी और अवरोधकों की उपस्थिति में वायरस एंटीबॉडी के साथ जुड़ता है; एंटीबॉडी वाला वायरस एक मजबूत बंधन बनाता है।
सीरम अवरोधकों के अलावा, अवरोधकों का वर्णन पक्षियों सहित जानवरों के ऊतकों, स्रावों और उत्सर्जन के साथ-साथ सेल संस्कृतियों में भी किया जाता है।
इंटरफेरॉन सिस्टम (आईएफएन). 1957 में अंग्रेजी वायरोलॉजिस्ट ए। इसाक और जे। लिंडमैन ने पाया कि वायरस से संक्रमित कोशिकाएं एक विशेष पदार्थ उत्पन्न करती हैं जो समरूप और विषम दोनों प्रकार के वायरस के प्रजनन को रोकती है, जिसे वे इंटरफेरॉन कहते हैं। यह स्थापित किया गया है कि एक इंटरफेरॉन नहीं है, बल्कि उनमें से एक पूरी प्रणाली है, जिसमें तीन मुख्य प्रकार प्रतिष्ठित हैं।
1980 में WHO के एक विशेष आयोग द्वारा इंटरफेरॉन का नामकरण विकसित किया गया था।
प्रत्येक प्रकार के भीतर उपप्रकार होते हैं, उदाहरण के लिए, α-इंटरफेरॉन में उनमें से लगभग 20 होते हैं। स्वभाव से, इंटरफेरॉन ग्लाइकोप्रोटीन होते हैं। वे कोशिका के आनुवंशिक तंत्र में एन्कोडेड हैं। मनुष्यों में, इंटरफेरॉन जीन गुणसूत्रों 2, 5, 9 और 11 पर स्थानीयकृत होते हैं।
इंटरफेरॉन प्रणाली में एक केंद्रीय अंग नहीं होता है, क्योंकि कशेरुकियों के शरीर की सभी कोशिकाओं में इंटरफेरॉन का उत्पादन करने की क्षमता होती है, हालांकि सफेद रक्त कोशिकाएं (ल्यूकोसाइट्स, टी-लिम्फोसाइट्स, एनके, मैक्रोफेज, आदि) इसे सबसे अधिक सक्रिय रूप से उत्पन्न करती हैं।
इंटरफेरॉन अनायास कोशिकाओं द्वारा निर्मित नहीं होता है। इसके गठन के लिए, एक प्रारंभ करनेवाला की आवश्यकता होती है (वायरस, जीवाणु विषाक्त पदार्थ, सिंथेटिक पदार्थ, डबल-फंसे वायरल आरएनए)।
इंटरफेरॉन का प्रेरण उसके जीन के विक्षोभ के कारण होता है (α-इंटरफेरॉन के लिए ऑपेरॉन में 12 संरचनात्मक जीन होते हैं)। इंटरफेरॉन के लिए mRNA का प्रतिलेखन और कोशिका के राइबोसोम पर इसका अनुवाद होता है।
प्रारंभ करनेवाला और सेल की बातचीत और इंटरफेरॉन (अंतराल अवधि) की उपस्थिति के बीच का समय अंतराल आमतौर पर 4-8 घंटे तक रहता है। इंटरफेरॉन सीधे वायरस से बातचीत नहीं करता है, सेल पर वायरस के सोखने को रोकता नहीं है और इसके उसमें प्रवेश।
इंटरफेरॉन का एंटीवायरल प्रभाव किसी भी नए प्रोटीन के संश्लेषण से जुड़ा नहीं है, लेकिन सेलुलर चयापचय (प्रोटीन किनेसेस और सिंथेटेस) के कई प्रमुख एंजाइमों की गतिविधि में वृद्धि में प्रकट होता है। नतीजतन, दीक्षा और अनुवाद के चरण अवरुद्ध हो जाते हैं और वायरल mRNAs नष्ट हो जाते हैं - यह विभिन्न वायरस के कारण होने वाले संक्रमणों में इंटरफेरॉन की कार्रवाई के सार्वभौमिक तंत्र को निर्धारित करता है। इंटरफेरॉन के सबसे विशिष्ट गुण: ऊतक विशिष्टता। यह सजातीय प्रणालियों में सक्रिय है और विषम जीवों में गतिविधि को तेजी से कम करता है (इसलिए, मानव मूल के इंटरफेरॉन मानव उपचार के लिए उपयोग किए जाते हैं);
वायरस की एक विस्तृत श्रृंखला के खिलाफ सार्वभौमिकता, यानी इसमें वायरस के लिए विशिष्टता नहीं है, हालांकि विभिन्न वायरस में इंटरफेरॉन के प्रति असमान संवेदनशीलता है;
उच्च दक्षता। इसकी छोटी खुराक में एंटीवायरल गतिविधि होती है।
इंटरफेरॉन के गुणों के अध्ययन से पता चला है कि उनके पास जीवाणुरोधी गुण (विशेषकर ग्राम-पॉजिटिव बैक्टीरिया के खिलाफ), एंटीट्यूमर गतिविधि और इम्यूनोमॉड्यूलेटरी गुण भी हैं। इंटरफेरॉन प्राकृतिक हत्यारे कोशिकाओं और साइटोटोक्सिक टी-लिम्फोसाइटों की गतिविधि को उत्तेजित करते हैं, उन्हें लक्षित कोशिकाओं की संवेदनशीलता में वृद्धि करते हैं, फागोसाइटोसिस, एंटीबॉडी गठन, पूरक निर्धारण आदि को उत्तेजित करते हैं।
विभिन्न इंटरफेरॉन की जैविक गतिविधि को अलग-अलग डिग्री में व्यक्त किया जा सकता है, उदाहरण के लिए, α- और β-इंटरफेरॉन में γ-इंटरफेरॉन की तुलना में उच्च एंटीवायरल गतिविधि होती है, जिसमें कई गुना अधिक इम्यूनोमॉड्यूलेटरी गतिविधि होती है।
शरीर के प्रतिरोध को निर्धारित करने वाले कारकों में से एक इंटरफेरॉन का उत्पादन करने के लिए इसके ऊतकों की क्षमता है। विभिन्न जानवरों में, यह समान नहीं है और जीव की जन्मजात विशेषताओं द्वारा निर्धारित किया जाता है, उम्र (नवजात शिशुओं का इंटरफेरॉन वयस्क जानवरों के इंटरफेरॉन की तुलना में कम एंटीवायरल प्रभाव प्रदर्शित करता है)। इसके अलावा, शरीर के ऊतकों द्वारा इंटरफेरॉन का उत्पादन बाहरी परिस्थितियों से भी प्रभावित होता है, उदाहरण के लिए, मौसम, हवा का तापमान (सर्दियों और शरद ऋतु में, शरीर गर्म मौसम की तुलना में कम इंटरफेरॉन का उत्पादन करता है), जानवरों के आयनकारी विकिरण में कमी आती है। अंतर्जात इंटरफेरॉन के उत्पादन में।
व्यवहार में, इंटरफेरॉन का उपयोग करने के दो तरीके हैं: कई वायरल संक्रमणों (इन्फ्लूएंजा, हेपेटाइटिस बी, हरपीज और घातक नियोप्लाज्म) की रोकथाम और उपचार के लिए तैयार बहिर्जात समरूप इंटरफेरॉन का उपयोग। रोग के प्रारंभिक चरण में दवा अधिक प्रभावी है; शरीर में अंतर्जात इंटरफेरॉन का प्रेरण। इसकी अभिव्यक्ति अच्छी तरह से ज्ञात है जब न्यूकैसल रोग वायरस के टीके के उपभेदों के साथ-साथ लैपिनाइज्ड स्ट्रेन एल 3 और रिंडरपेस्ट वायरस के एलटी को पक्षियों को प्रशासित किया जाता है।
वर्तमान में, इंटरफेरॉन का उत्पादन आनुवंशिक इंजीनियरिंग विधि द्वारा किया जाता है।
हत्यारा कोशिकाएं. 1976 में, लिम्फोइड ऊतक में प्राकृतिक हत्यारे पाए गए - एनके कोशिकाएं (अंग्रेजी से। प्राकृतिक हत्यारा - प्राकृतिक हत्यारा), उन्हें प्राकृतिक हत्यारे (एनके कोशिकाएं) भी कहा जाता है। वे अस्थि मज्जा में पूर्वज कोशिकाओं से प्राप्त होते हैं। रक्त में एनके कोशिकाओं की सामग्री लिम्फोसाइटों की कुल संख्या का 5-20% है, यकृत में - 42%, प्लीहा में - 36, लिम्फ नोड्स में - 3, फेफड़ों में - 5, छोटी आंत में - 3 और अस्थि मज्जा में - 2%। टी-साइटोटॉक्सिक लिम्फोसाइटों के विपरीत, एनके कोशिकाओं की हत्यारा गतिविधि एमएचसी वर्ग I अणुओं द्वारा विदेशी एंटीजन की प्रस्तुति पर निर्भर नहीं करती है।
एनके कोशिकाओं द्वारा लक्ष्य कोशिकाओं की पहचान और विनाश के लिए पूर्व संवेदीकरण (टीकाकरण) की आवश्यकता नहीं होती है और यह स्मृति कोशिकाओं के गठन के साथ नहीं होता है। हालांकि, एनके कोशिकाएं ट्यूमर के विकास, ट्यूमर मेटास्टेस और वायरल संक्रमण के खिलाफ शरीर की रक्षा करने में महत्वपूर्ण भूमिका निभाती हैं - उत्परिवर्तित और वायरस से संक्रमित कोशिकाओं के उन्मूलन में, प्रत्यारोपण अस्वीकृति। अनिवार्य रूप से, प्राकृतिक हत्यारे अन्य, विशिष्ट, प्रतिरक्षा तंत्र सक्रिय होने से पहले शरीर की पहली रक्षा प्रतिक्रिया में शामिल होते हैं। एनके कोशिकाएं लक्ष्य कोशिकाओं के विश्लेषण का कारण बनती हैं जो एंटीबॉडी और पूरक से स्वतंत्र होती हैं, और साथ ही साथ फागोसाइटोसिस की क्षमता नहीं होती है। एनके कोशिकाओं का साइटोटोक्सिक कारक एक विशेष प्रोटीन है, जो इसके भौतिक रासायनिक और प्रतिरक्षात्मक गुणों में प्रोटीन पेर्फोरिन के समान होता है, जो लक्ष्य कोशिकाओं की झिल्ली में छिद्रों के गठन का कारण बनता है। एनके कोशिकाओं में ग्रैनजाइम भी होते हैं जो लक्ष्य कोशिकाओं में प्रवेश करने पर एपोप्टोसिस (क्रमादेशित कोशिका मृत्यु) को शामिल करने का कारण बनते हैं।
लक्ष्य कोशिकाओं के विश्लेषण के बाद, एनके कोशिकाएं व्यवहार्य रहती हैं, लक्ष्य से मुक्त हो जाती हैं और एक नए लक्ष्य सेल (पुनर्नवीनीकरण एनके कोशिकाओं) के साथ बातचीत कर सकती हैं। एनके कोशिकाएं प्रतिरक्षा प्रतिक्रिया के रूप में तैयारी के बिना लक्ष्य कोशिकाओं को जल्दी (1-2 घंटे) मार देती हैं, जो उन्हें टी-लिम्फोसाइटों से अलग करती है।
एनके कोशिकाओं के अलावा, एंटीबॉडी-निर्भर के-कोशिकाओं (एंटीबॉडी-निर्भर सेल-मध्यस्थता साइटोटोक्सिसिटी - एडीसीसी) में प्राकृतिक साइटोटोक्सिसिटी होती है जो पिछले टीकाकरण के कारण नहीं होती है।
मैक्रोफेज, इंटरफेरॉन, पूरक, मुख्य हिस्टोकोम्पैटिबिलिटी कॉम्प्लेक्स, टी-लिम्फोसाइट्स और प्राकृतिक हत्यारों की प्रणालियों की अच्छी तरह से समन्वित बातचीत के लिए धन्यवाद, विशिष्ट प्रतिरक्षा के अधिग्रहण से पहले, सभी आनुवंशिक रूप से विदेशी पदार्थों (सूक्ष्मजीवों और उत्परिवर्ती) की समय पर पहचान और विनाश। सेल) सुनिश्चित किया गया है। नतीजतन, शरीर की संरचनात्मक और कार्यात्मक अखंडता संरक्षित है।
साथ ही, ये प्रणालियां अधिग्रहित (विशिष्ट) प्रतिरक्षा के गठन के आधार के रूप में कार्य करती हैं, और उनके स्तर पर, विशिष्ट और अधिग्रहित प्रतिरक्षा विलय हो जाती है, जिससे शरीर की आत्मरक्षा की एक और सबसे प्रभावी प्रणाली बनती है।
यदि आपको कोई त्रुटि मिलती है, तो कृपया टेक्स्ट के एक भाग को हाइलाइट करें और क्लिक करें Ctrl+Enter.
अपरिवर्तनीय निषेध के साथ, इसकी गतिविधि की अभिव्यक्ति के लिए आवश्यक एंजाइम के कार्यात्मक समूहों का बंधन या विनाश होता है।
उदाहरण के लिए, पदार्थ डायसोप्रोपाइलफ्लोरोफॉस्फेटएंजाइम की सक्रिय साइट में सेरीन के हाइड्रॉक्सी समूह के लिए दृढ़ता से और अपरिवर्तनीय रूप से बांधता है एसिटाइलकोलिनेस्टरेज़तंत्रिका सिनैप्स पर हाइड्रोलाइजिंग एसिटाइलकोलाइन। इस एंजाइम का निषेध अन्तर्ग्रथनी फांक में एसिटाइलकोलाइन के टूटने को रोकता है, जिसके परिणामस्वरूप मध्यस्थ अपने रिसेप्टर्स पर कार्य करना जारी रखता है, जो अनियंत्रित रूप से कोलीनर्जिक विनियमन को बढ़ाता है। मुकाबला उसी तरह काम करता है। organophosphates(सरीन, सोमन) और कीटनाशकों(कार्बोफोस, डाइक्लोरवोस)।
एसिटाइलकोलिनेस्टरेज़ के अपरिवर्तनीय निषेध का तंत्र
एक और उदाहरण निषेध से संबंधित है एसिटाइलसैलीसिलिक अम्ल(एस्पिरिन) प्रोस्टाग्लैंडीन के संश्लेषण में एक प्रमुख एंजाइम - साइक्लोऑक्सीजिनेज. यह एसिड विरोधी भड़काऊ दवाओं का हिस्सा है और इसका उपयोग सूजन संबंधी बीमारियों और बुखार की स्थिति में किया जाता है। एंजाइम की सक्रिय साइट में अमीनो समूह के लिए एसिटाइल समूह का जुड़ाव बाद के निष्क्रिय होने और प्रोस्टाग्लैंडीन संश्लेषण की समाप्ति का कारण बनता है।

साइक्लोऑक्सीजिनेज के अपरिवर्तनीय निषेध का तंत्र
प्रतिवर्ती निषेध
प्रतिवर्ती निषेध के साथ, अवरोधक एंजाइम के कार्यात्मक समूहों के लिए दृढ़ता से बाध्य नहीं है, जिसके परिणामस्वरूप एंजाइम की गतिविधि धीरे-धीरे बहाल हो जाती है।
प्रतिवर्ती अवरोधक का एक उदाहरण है प्रोजेरिनजो एक एंजाइम को बांधता है एसिटाइलकोलिनेस्टरेज़अपने सक्रिय केंद्र में। एन्सेफलाइटिस, मेनिन्जाइटिस और सीएनएस चोटों के बाद, मायस्थेनिया ग्रेविस के लिए कोलिनेस्टरेज़ इनहिबिटर (प्रोज़ेरिन, डिस्टिग्माइन, गैलेंटामाइन) के एक समूह का उपयोग किया जाता है।
प्रतिस्पर्धी निषेध
इस प्रकार के निषेध में, अवरोधक संरचनात्मक रूप से एंजाइम के सब्सट्रेट के समान होता है। इसलिए, यह सक्रिय साइट के लिए सब्सट्रेट के साथ प्रतिस्पर्धा करता है, जिससे एंजाइम के लिए सब्सट्रेट के बंधन में कमी आती है और कटैलिसीस में व्यवधान होता है। यह प्रतिस्पर्धी निषेध की विशेषता है, अर्थात, सब्सट्रेट की एकाग्रता में परिवर्तन के माध्यम से अवरोध को बढ़ाने या कमजोर करने की क्षमता।
उदाहरण के लिए:
1. प्रतिस्पर्धी बातचीत इथेनॉलतथा मेथनॉलसक्रिय केंद्र के लिए अल्कोहल डिहाइड्रोजनेज.
2. निषेध सक्सेनेट डिहाइड्रोजनेज मेलोनिक एसिड, जिसकी संरचना इस एंजाइम के सब्सट्रेट की संरचना के समान है - succinic acid (succinate)।