Техника посева микроорганизмов Бактериологический метод-выделение чистых культур микробов и их последующая идентификация - имеет большое значение в диагностике инфекционных заболеваний, при изучении санитарно-гигиенического состояния объектов внешней среды (вода, воздух, почва, продукты питания) и исследовании их по эпизоотическим и эпидемиологическим показателям на зараженность патогенными видами микробов. Однако первым этапом этой методики является посев или пересев бактериальной культуры на различные типы питательной среды.
Материалом для посева могут быть пересеваемые культуры бактерий, различные выделения животных и человека, ткани трупа, вода, почва, продукты питания.
Жидкий материал для посева берут петлей или пипеткой. При взятии петлей жидкость должна образовать в кольце петли тонкую прозрачную пленку - «зеркало». Пипетками пользуются в том случае, когда материал засевают в большом или точно отмеряемом объеме.
Рис. 4. Схема пересева культуры микробов из пробирки в пробирку
Способ взятия плотного материала определяется его консистенцией. При посевах чаще всего пользуются бактериальной петлей. Все манипуляции, связанные с посевом и выделением микробных культур, производят над пламенем горелки. Бактериальную петлю прокаливают над пламенем непосредственно перед взятием материала, затем петлю остужают. Для этого при пересеве микробной культуры с пробирки горячую петлю погружают в конденсационную жидкость, а при пересеве с чашек Петри прикасаются к поверхности питательной среды, свободной от микробного роста. Достаточно остуженная петля не вызывает шипения конденсационной жидкости и не растапливает агар при соприкосновении со средой. После окончания посева петлю прожигают повторно для уничтожения находящейся на ней микробной культуры или инфицированного микроорганизмами материала.
Пипетки и шпатели, используемые для посевов, так же, как и бактериальные петли, перед посевом прожигают, а после посевов опускают в дезинфицирующий раствор.
Перед посевом вся посуда проверяется на целостность, далее, на чашках Петри со стороны дна, на пробирках в верхней трети, надписывают название засеянного материала или ставят номер анализа и дату посева.
Техника посевов на плотные и жидкие питательные среды
1. При посеве в жидкую питательную среду петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый в пастеровскую или градуированную пипетку, вливают в питательную среду.2. При посеве на скошенный мясо-пептонный агар пробирку берут в левую руку между I и II пальцами, чтобы основание пробирки находилось на поверхности кисти руки и посев осуществлялся под контролем глаза. Пробку из пробирки вынимают правой рукой V и IV пальцами, не прикасаясь к той части пробки, которая входит внутрь пробирки. Остальные 3 пальца правой руки остаются свободными для взятия бактериальной петли, посредством которой производится посев. Петлю держат, как писчее перо. После вынимания пробки пробирку с питательной средой держат в наклонном положении во избежание попадания в нее посторонних микроорганизмов из воздуха.
Петлю с находящимся на ней пересеваемым материалом вводят в пробирку до дна, опускают плашмя на поверхность питательной среды и скользящими движениями наносят штрих снизу вверх, от одной стенки пробирки к другой (рис. 4).
3. При посеве на поверхность плотной питательной среды в чашки Петри чашку держат в левой руке. Дно ее с одной стороны придерживают I и II пальцами, а с другой - IV и V пальцами. Крышку, приоткрытую настолько, чтобы в образовавшуюся щель свободно проходили петля или шпатель, фиксируют I и III или I и II пальцами. Небольшое количество исследуемого материала втирают бактериальной петлей в поверхность питательной среды у края чашки (рис. 5). Затем петлю прожигают, чтобы уничтожить избыток находящегося на ней материала. Линию посева начинают с того места, в котором находится материал. Бактериальную петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхности, и проводят штрихи по всей среде или по секторам, разграфив предварительно дно чашки (при условии, что среда прозрачна) на несколько равных частей. Нужно стараться, чтобы штрихи, наносимые петлей, располагались как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность получить изолированные колонии микроорганизмов.
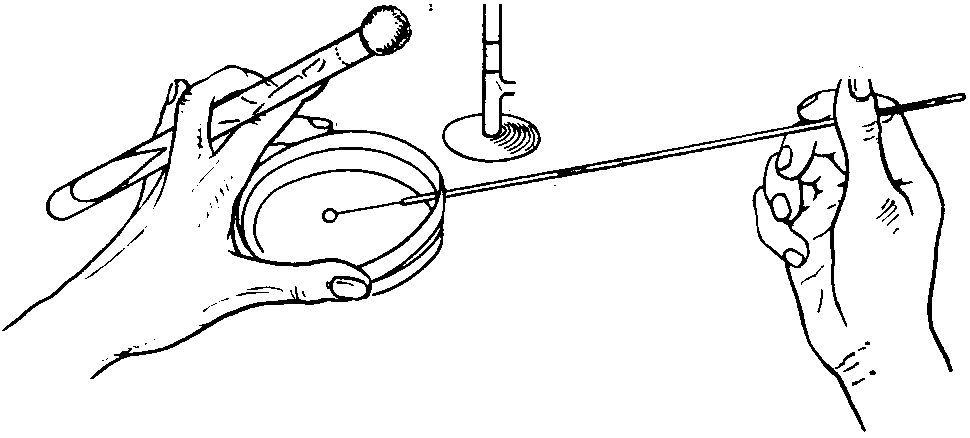
Рис. 5. Посев на плотную питательную среду в чашки Петри
Для равномерного распределения засеваемого материала по поверхности плотной питательной среды можно пользоваться вместо петли тампоном или шпателем.
При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного, или газонного. Посев газоном производят, когда нужно получить большие количества микробной культуры одного вида.
4. Из материала, подлежащего посеву в толщу плотной питательной среды, готовят взвесь в стерильной водопроводной воде или в изотоническом растворе. Набирают 0,1-1 мл взвеси в пипетку (в зависимости от степени предполагаемого микробного загрязнения) и выливают в пустую стерильную чашку Петри. Вслед за этим чашку заливают 15-20 мл мясо-пептонного агара, расплавленного и остуженного до температуры 40-45°С (при такой температуре пробирка со средой, приложенная к щеке, не должна вызывать ощущения ожога). Для равномерного распределения исследуемого материала в питательной среде закрытую чашку с содержимым слегка вращают по поверхности стола.
5. Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку, как обычно, и в центре столбика до дна пробирки вкалывают петлю с находящимся на ней материалом.
Получение чистых культур
Чистой культурой микробов называют популяцию микроорганизмов одного вида, полученную из изолированной микробной колонии. Под микробной колонией подразумевается потомство бактерий, возникающее в результате размножения одной микробной клетки.Выделение чистой культуры микробов является обязательным этапом всякого бактериологического исследования. Чистая культура необходима для изучения морфологических, культур культуральных, биохимических и антигенных свойств, по совокупности которых определяется видовая принадлежность исследуемого микроорганизма.
Для выделения чистых культур микробов из материалов, содержащих обильную смешанную микрофлору, предложено много различных методов. Наибольшее распространение получил метод механического разъединения микроорганизмов, находящихся в исследуемом материале, с целью получения изолированных колоний на поверхности или в глубине питательной среды.
Очень широко применяются элективные питательные среды, стимулирующие развитие тех микроорганизмов, чистую культуру которых предполагается выделить.
Некоторые виды микробов обладают высокой чувствительностью к воздействию определенных факторов внешней среды. Индивидуальная устойчивость микробов к тому или иному фактору была использована для разработки методов выделения чистых культур путем умерщвления сопутствующей микрофлоры. Этим способом производится выделение споpoвых форм микробов, устойчивых к действию высокой температуры, микобактерий туберкулеза, безразличных к действию концентрированных растворов минеральных кислот, в отличие от остальных микробов, содержащихся в мокроте.
При выделении чистой культуры патогенных микробов из патологического материала, загрязненного посторонней микрофлорой, прибегают иногда к заражению лабораторных животных, восприимчивых к тому виду микроба, который предполагается выделить из исследуемого материала. Биологический метод выделения чистой культуры применяется при исследовании мокроты на содержание в ней пневмококков, микобактерий туберкулеза.
Для выделения бактерий в виде чистых культур известно сравнительно мало методов. Чаще всего это делают путем изолирования отдельных клеток на твердой питательной среде, используя метод посева штрихом или разлива по чашкам небольшого количества жидкой культуры. Однако получение отдельной колонии не всегда гарантирует чистоту культуры, поскольку колонии могут вырасти не только из отдельных клеток, но из их скоплений. Если микроорганизмы образуют слизь, то к ней часто прикрепляются посторонние формы. В случае выделения штаммов Bacillus или актиномицетов контаминирующие микроорганизмы могут быть опутаны цепочками клеток или, соответственно, гифами этих микробов. Для очистки предпочтительнее использовать неселективную среду, поскольку на ней лучше растут контаминирующие микроорганизмы и их легче обнаружить. Но даже на неселективной среде не следует очень быстро отбирать колонии, поскольку за данный отрезок времени могут не вырасти медленно растущие контаминирующие бактерии.
Из чистой культуры обычно вырастают одинаковые колонии и при микроскопировании выявляются похожие клетки, в частности, по размеру и окраске по Граму. Однако возможны исключения, например, колонии, вырастающие из чистой культуры, могут быть гладкие (S) и шероховатые (R). Кроме того, в чистых культурах различных микроорганизмов могут появиться кокковидные клетки, цисты и споры. Наконец, некоторые микроорганизмы проявляют грамвариабельность. Тем не менее, указанные критерии широко используются при определении чистоты культур.
Посев штрихом
Существует много методов посева штрихом в чашки с твердыми средами («штрихованные чашки»), но лишь некоторые из них почти всегда дают изолированные колонии даже при отсутствии навыков у экспериментатора. Кроме того, можно наливать разведенные растворы смешанной культуры на поверхность твердых сред в чашках. При работе с анаэробами «штрихованные чашки» или чашки с внесенной в них жидкой культурой в атмосфере воздуха инкубируют затем в анаэростате. Для анаэробов необходимы свежеприготовленные среды, и посев штрихом следует проводить в течение первых 4 ч после их автоклавирования, чтобы избежать накопления растворенного кислорода.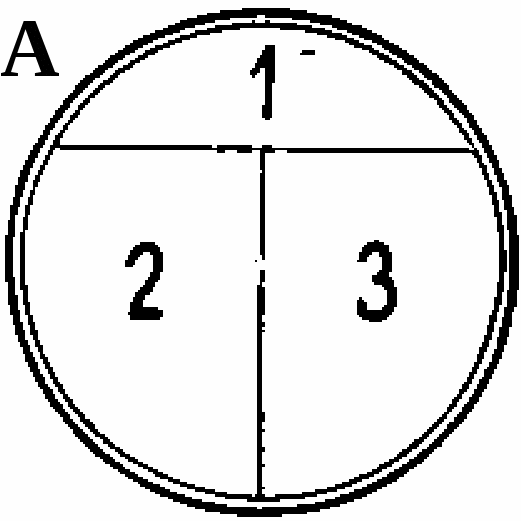

В
 Г
Г

 Д
Д
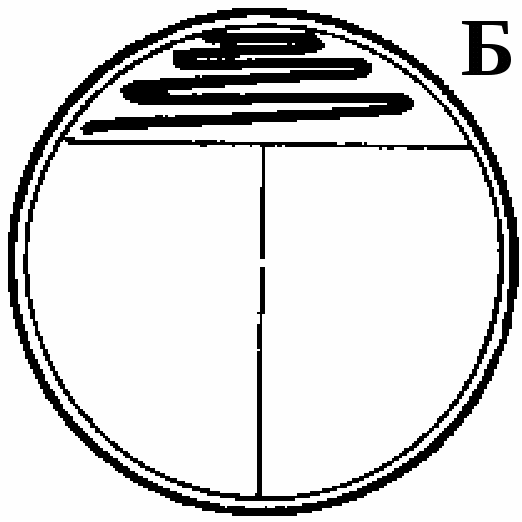
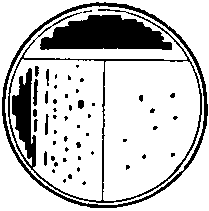
Рис. 6. Удобный метод посева штрихом в чашки для получения отдельных колоний. А. Для маркировки на обратной стороне чашки Петри карандашом наносят букву Т, разделяющую дно на 3 сектора. Б. Петлей с культурой зигзагом наносят штрихи на поверхности агара в секторе 1, как показано на рисунке. Для этого крышку чашки сначала приподнимают, а после нанесения штриха сразу закрывают. Петлю стерилизуют в пламени и дают ей остыть (15 с). В. Проводят петлей по поверхности среды в секторе 1, как показано на рисунке, и затем немедленно наносят ею зигзагом штрихи на поверхности среды в секторе 2. Прогревают петлю в пламени и дают ей остыть. Г. Проводят петлей по поверхности среды в секторе 2, как показано, и затем наносят ею зигзагом штрихи на поверхности среды в секторе 3. Д. Инкубируют опрокинутые вверх дном чашки, как показано на рисунке, для того, чтобы конденсирующаяся вода с крышки не попала на поверхность агара. В секторе 1 вырастает большое число колоний, тогда как в секторах 2 и 3 появляются отдельные хорошо изолированные колонии.
Получение чистой культуры методом рассева в глубине среды (по Коху)
Три пробирки, содержащие по 15 мл мясо-пептонного агара, ставят в водяную баню для расплавления агара. Расплавленную среду остужают до температуры 43-45°С. В пробирку вносят одну бактериальную петлю исследуемого материала. Для лучшего перемешивания материала со средой засеянную пробирку вращают несколько раз, зажав между ладонями. После этого прокаленной и остуженной петлей содержимое 1-й пробирки переносят во 2-ю и таким же образом из 2-й в 3-ю. Приготовленные разведения микробов выливают из пробирок в стерильные чашки Петри, обозначенные номерами, соответствующими номерам пробирок.После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Выделение чистой культуры по способу Дригальского
Расплавленную питательную среду разливают в три чашки Петри. Застывшую среду обязательно подсушивают, так как влажная поверхность ее способствует образованию сливающегося роста. В первую чашку вносят одну каплю исследуемого материала и стерильным шпателем втирают его в поверхность питательной среды. Далее, не прожигая шпателя и не набирая нового материала, шпатель переносят во вторую и третью чашки, втирая в поверхность питательных сред оставшийся на нем материал.Метод рассева по поверхности, предложенный Дригальским, является наиболее употребительным для получения чистой культуры микробов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют параллельными штрихами по всей чашке в одном направлении. Затем, повернув чашку на 180°, проводят штрихи в направлении, перпендикулярном первым штрихам. При таком способе посева материал, находящийся на петле, расходуется постепенно, и по линиям сетки, нанесенным в конце посева, вырастают изолированные колонии микробов.
Анаэростат для культивирования анаэробов
Анаэростат - прибор для выращивания микробов в анаэробных условиях. Представляет собой толстостенный металлический цилиндр с герметически привинчивающейся крышкой, на которой имеются вакуумметр и два крана для присоединения к вакуум-насосу.Материал на бактериологическое исследование забирается в стерильную посуду до
начала антибактериальной терапии.
Доставлять с соблюдением сроков в биксе без переохлаждения.
КРОВЬ
На стерильность (микрофлору, гемокультуру) забирать с соблюдением асептики во время подъема температуры в подогретую до 37 С питательную «двойную» среду в количестве 10 мл у взрослых и 0.1-5 мл у детей (в соотношении 1:10). Забор крови осуществляют вдвоем: один обрабатывает кожу, пунктирует вену и берет кровь в шприц, второй над пламенем спиртовки открывает пробки флаконов, подставляет под струю крови из шприца, обжигает горлышко флаконов или пробирки, закрывает их и гомогенизирует, чтобы не было сгустков крови. По показаниям одновременно делается мазок на предметном стекле. Доставлять без переохлаждения. Рекомендуется забирать кровь одновременно в три флакона. В вечерние, ночные часы и в воскресенье флаконы с кровью помещать в термостат на 37 С в клинической лаборатории.
МОЧА
На микрофлору забирается утренняя (накопительная) средняя порция мочи после туалета наружных половых органов в количестве 3-5 мл. Доставлять не позднее 2 часов при условии хранения в холодильнике. При уретрите, цистите - забор первой порции мочи.
МОКРОТА
Перед забором почистить зубы, прополоскать рот свежей кипяченой водой или раствором антисептика, без усилий собрать утреннюю (накопительную) мокроту без слюны в количестве 1-5 мл. Доставлять не позднее 2 часов с момента забора.
1. При заболеваниях - стерильным ватным тампоном раздельно для каждого носового
хода из глубоких отделов, предварительно освободив нос от слизи. При сухой
слизистой - увлажненным 0.9% раствором NaCl ватным тампоном.
2. На носительство золотистого стафилококка - из передних отделов полости носа
одним тампоном из обеих носовых ходов, не касаясь кожи носа. Доставлять в
Натощак или через 2 часа после приема пищи, жидкости.
1. На дифтерию - с помощью шпателя тампоном на границе здоровой и пораженной
ткани. Одновременно мазок тампоном из обеих носовых ходов.
При подозрении на дифтерию - 2 или 3 тампона из зева для прямой бактериоскопии, постановки опыта на токсигенность, посева. По показаниям - мазок из мест редкой локализации, зева, носа. Доставлять в течение 2 часов без переохлаждения. В вечерние, ночные часы, воскресенье материал опускать в теплую среду обогащения и хранить в термостате +37 С.
2. На микрофлору - с помощью шпателя ватным тампоном обтереть правую
миндалину, дужки, язычок, левую миндалину, заднюю стенку глотки. Не касаться
слизистой рта, языка! Доставлять в течение 2 часов без переохлаждения.
3. На менингококк - забор и посев у постели больного или лаборатории производит
лаборант, врач-бактериолог с задней стенки носоглотки с помощью шпателя
тампоном, изогнутым под углом 45 в нижней % его длины о пробирку. Доставка и
посев немедленно!
4. На коклюш - у постели больного или в лаборатории производит лаборант с задней
стенки глотки (тампон вниз) изогнутым ватным тампоном под углом 45 . Доставка
и посев немедленно, без переохлаждения.
5. На микоз - ватным тампоном с пораженных участков слизистой. Доставлять в
течение 2 часов без переохлаждения.
ПРОМЫВНЫЕ ВОДЫ БРОНХОВ
В стерильную пробирку в количестве 5 мл. Доставлять в течение 2 часов без переохлаждения.
ЛИКВОР
Последние порции в количестве 1-3 мл в стерильную пробирку с соблюдением правил асептики над спиртовкой. Доставлять немедленно в теплом пенале или помещать на 37 в термостат.
ОТДЕЛЯЕМОЕ РАН
Кожу вокруг раны предварительно обработать раствором антисептика, некротические массы, детрит, гной удалить стерильной салфеткой. Забор материала производить ватным тампоном круговыми вращательными движениями от центра к периферии. По показаниям - 2 тампона, один для нативной бакткриоскопии.
По Cito! - 3 тампона для бактериоскопии, посева и постановки чувствительности к антибиотикам. При наличии в ране дренажа, катетера - внутренняя часть отрезается стерильными ножницами и помещается в флакон с питательной средой. Доставлять в течение 1-2 часов без переохлаждения. Вне часов работы лаборатории материал берется в среду обогащения и хранится в термостате при 37 С в клинической лаборатории.
ПУНКТАТЫ. МАТЕРИАЛ НА АНАЭРОБЫ. ОТДЕЛЯЕМОЕ ГЛУБОКИХ РАН. КУСОЧКИ ТКАНЕЙ
Нативные материалы в шприце в количестве 0.5-3 мл, на конец иглы -резиновую пробирку, завернув в стерильную салфетку, в течение 0.5-2 ч. Кусочки тканей, нативный материал в количестве 0.5-3 мл поместить в стерильные флаконы, пробирки. Доставка в течение 2 часов или с тиогликолевой средой - доставка в течение 12-24 часов.
ГЛАЗА
За 5-6 часов до забора отменить все процедуры и медикаменты. Конъюктива - ватным тампоном со слизистой от наружного к внутреннему краю, не касаясь кожи, раздельно с каждого глаза.
Секрет слезного мешка - после массажа отделяемое ватным тампоном.
Края век - удалить корочки, взять тампоном из язвочек у основания ресниц или выдернуть несколько ресниц и погрузить в питательную среду. Доставлять в течение 2 часов без переохлаждения.
ПОЛОВЫЕ ОРГАНЫ
«С» канал - ватным тампоном в зеркалах до мануального исследования предварительно обработав влагалищную часть ватным тампоном, смоченным физиологическим раствором, не касаясь стенок влагалища.
Вульва - до мануального исследования, после введения зеркала и подъемника брать ватным тампоном с патологически измененных участков.
Матка, придатки матки - при оперативном вмешательстве брать экссудат, кусочки органов во флакон или пробирку с питательной средой.
Отделяемое уретры - после туалета наружных половых органов брать ватным тампоном, не касаясь кожи. Доставлять в чеченце 1-2 часов без переохлаждения.
По показания параллельно с взятием материала врач-гинеколог (врач-уролог) готовит мазки на предметном стекле, используя отдельные стерильные ватные тампоны или гинекологические инструменты, равномерно распределяя материал без грубого втирания и резких штриховых движений.
НА УРЕАПЛАЗМОЗ
Без антибиотиков в течение 2 недель, до провокации.
У мужчин:
из уретры, не мочиться в течение 4-6 часов, головку полового члена обработать стерильным ватным тампоном, смоченным 0.8% раствором NuCl в области наружного отверстия. Первые капли выделений удалить, а последующие посеять. Если нет выделений, то соскоб ложкой Фолькмана на глубину 2-3 см.; 10 мл первой мочи, сеять осадок.
У женщин:
из уретры после массажа через влагалище ложкой Фолькмана соскоб в питательную среду.
Из «С» канала, заднего свода влагалища после предварительной обработки стерильным ватным тампоном, смоченным стерильным 0.8% раствором NaCl соскоб ложкой Фолькмана.
Питательная среда после посева должна быть доставлена в лабораторию в течение 1 часа или поместить на 37 о С в термостат.
ЖЕЛЧЬ
При зондировании при заборе желчи в клиническую лабораторию отдельно порции А, В, С в три стерильные пробирки в количестве 2-5 мл, либо во время операции с помощью шприца в пробирку, соблюдая правила асептики. Доставлять в течение 2 часов.
ГРУДНОЕ МОЛОКО
С соблюдением правил асептики. После туалета молочных желез, предварительно сцедив первые капли в салфетку. Доставлять в количестве 1-3 мл в стерильных флаконах в течение 0.5-1 часа.
При поражении наружного уха обработать кожу 70 спиртом с последующим промыванием физиологическим раствором. Затем отделяемое из очага собирают ватным тампоном. Доставлять в течение 2 часов без переохлаждения.
При поражении среднего, внутреннего уха исследуют пунктаты и материал, полученный во время оперативных вмешательств, собранный в стерильную посуду или с питательной средой (вне часов работы лаборатории).
1. На дизентерию - первые порции, на сальмонеллы - последние порции, или
из судна без следов дез. растворов в количестве 0.5-1 г в пробирку с
глицериновым консервантом (хранить в холодильнике с момента взятия до 12
часов), или нативный в стерильной посуде. Доставлять в течение 2 часов.
2. На холеру - 0.5-1.5 г нативный или холерный консервант.
3. На дисбактериоз, грибы, патогенный стафилококк. УПМ (условно-патогенную
микрофлору) 1-2 г нативного кала в стерильные флаконы с соблюдением
правил асептики. Доставлять в течение 2 часов без переохлаждения.
Посев различных бактерий представляет собой один из наиболее эффективных и широко распространенных способов, который в настоящее время активно применяется в сфере медицинской микробиологии. Также данный метод незаменим в области биотехнологии, где он играет важную роль в изучении различных свойств как биологического, так и биохимического характера. Под данным методом подразумевается процесс культивирования микроскопических организмов с использованием , различающихся между собой по характеристикам и свойствам.
Бактериологические посевы могут проводиться с целью тщательного исследования отделяемых клеток глаз, половых органов человека, а также с целью максимально точного анализа крови, мочи или кала. Также выполняются бактериальные посевы спермы и мокроты для исследования. Довольно часто встречается процедура посева на .
Какими бывают среды для питания бактерий
При выборе среды для осуществления посева в первую очередь следует ориентироваться на характер содержания, присущего бактериям, которые являются главным объектом исследования. В том случае, если необходимо получить изолированные , а также определить чистую культуру, следует выполнять посев на плотные питательные среды.
Но если материал, подверженный исследованию, содержит в себе не очень большое количество микроорганизмов, можно в этих целях использовать жидкую питательную среду.
Существует несколько разновидностей питательных сред, в которых осуществляется бактериальный посев. Итак, принято различать простые и специальные среды, а также элективные и дифференциально-диагностические. Каждая категория сред питания отличается своими индивидуальными особенностями и характеристиками.
В каких случаях пациентам назначают анализ мочи с посевом бактерий?
Проведение анализа с бактериальным посевом мочи является актуальным в нескольких случаях:
- при наличии инфекционных заболеваний органов мочевыводящей системы;
- при заболевании сахарным диабетом;
- при беременности;
- с целью уточнения диагноза, если заболевание носит нетипичный характер.
Для проведения этого вида анализа требуется утренняя порция мочи пациента, приблизительное количество которой составляет от трех до пяти миллилитров. Перед сбором мочи на анализ пациент должен обязательно провести соответствующие гигиенические процедуры, однако применять при этом средства с антисептическими свойствами нельзя. Доставку собранной мочи для анализа необходимо производить в кратчайшие сроки. С этой целью применяется стерильный одноразовый контейнер, который гарантирует правильную транспортировку и максимально точные результаты.